Proteínas de la leche con actividades biológicas específicas / Miguel Calvo

Miguel Calvo
Departamento de Producción Animal y Ciencia de los Alimentos
![]() Facultad de Veterinaria - Universidad de Zaragoza
Facultad de Veterinaria - Universidad de Zaragoza
Instituto Agroalimentario de Aragón (IA2)
Las proteínas de la leche tienen evidentemente valor nutritivo para todos los mamíferos que las reciben en el periodo postnatal, pero también presentan cualidades relacionadas con funciones biológicas más complejas. Algunas han realizado su función en la glándula mamaria (la alfa-lactalbúmina interviene en la síntesis de la lactosa) y otras actúan en el recién nacido, especialmente en su defensa frente a microorganismos. Los detalles concretos dependen de la biología de cada especie. En la especie humana, las principales proteínas de defensa son la lactoferrina, las IgA, y la lisozima. En la especie bovina, las principales proteínas protectoras son las IgG y la lactoperoxidasa, mientras que el contenido de lactoferrina es muy bajo, salvo en la etapa calostral y en el periodo de secado. En la especie bovina, las IgG son captadas en el tubo digestivo del ternero y pasan a la circulación sanguínea, mientras que en la especie humana, que ya ha recibido la inmunidad pasiva a través de la placenta, la defensa es fundamentalmente frente a patógenos del tubo digestivo. Por otra parte, en la leche de vaca se encuentra una proteína, la beta-lactoglobulina, que es capaz de unir ácidos grasos, y cuya función biológica está probablemente asociada con la digestión de las grasas por parte del ternero. En la especie humana, este apoyo a la digestión viene dado por la presencia de una lipasa activada por sales biliares, que no se encuentra presente en la leche de vaca.
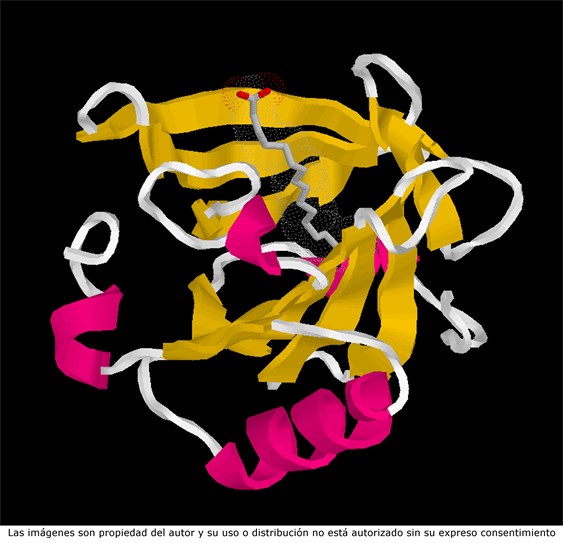
Representación de la estructura tridimensional de la beta-lactoglobulina, una proteína de la leche capaz de fijar una molécula de ácido graso de cadena larga.
La incorporación de proteínas con capacidad protectora frente a infecciones intestinales en las leches destinadas a alimentación infantil podría considerarse un avance significativo en la mejora de su calidad. De hecho, la lactoferrina bovina recuperada del lactosuero de quesería, del que se producen enormes volúmenes, y también del calostro, se utiliza desde hace bastantes años en Japón, y también ha llegado a España. Esta proteína tiene actividad antimicrobiana mediante varios mecanismos, siendo el mejor conocido su capacidad para fijar dos átomos de hierro por cada molécula de proteína, haciendo que así este elemento no se encuentre disponible para las bacterias, lo que impide su proliferación.
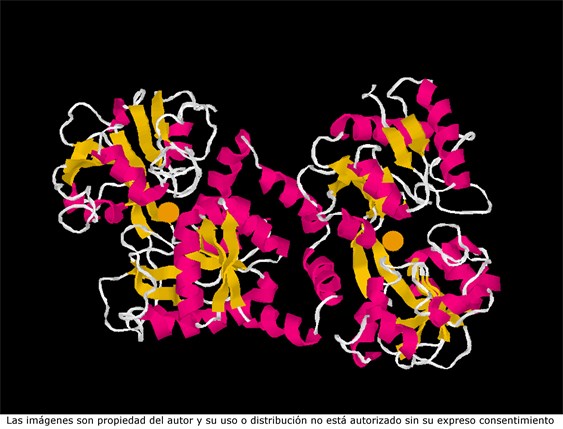
Representación de la estructura tridimensional de la lactoferrina, un proteína de la leche con acción protectora frente a microrganismos, que tiene unidos dos átomos de hierro.
La lactoferrina bovina presenta dos inconvenientes para su utilización en alimentos para niños, uno obvio, la diferencia de estructura con la proteína humana, y otro menos obvio, pero asimismo importante, la posibilidad de que la materia prima haya sido sometida a tratamientos térmicos que hayan podido alterar su estructura. Consecuentemente se han probado diferentes sistemas para obtener lactoferrina humana mediante métodos biotecnológicos, insertando el gen que la codifica en la especie humana en otros organismos. La lactoferrina es una glicoproteína por lo que la inserción del gen en una bacteria permitiría obtener la cadena polipeptídica, pero sin glicosilar, y por tanto es necesario utilizar organismos eucariotas para obtenerla. La aproximación más sencilla de las que se han utilizado, la inserción del gen humano en un hongo, presenta el problema de que el patrón de glicosilación que se encuentra es distinto al de las proteínas animales. Lo mismo sucede si el gen de la lactoferrina se inserta en el arroz, otra aproximación que también se ha puesto en práctica. Los tres glicanos unidos son mucho más pequeños que los de la lactoferrina humana, aunque en este caso presentaría la ventaja de que podría utilizarse directamente en forma de harina, sin necesidad de procesos de extracción. La lactoferrina humana recombinante obtenida en arroz se comercializa actualmente para su utilización como medicamento. Los últimos esfuerzos se han dirigido a la obtención de lactoferrina humana insertando el gen correspondiente en vacas, en algún caso asociado también al gen de la lisozima humana. El problema principal en este caso es conseguir que los animales sinteticen y secreten la proteína humana en su leche en una concentración suficientemente elevada.
Otro posible planteamiento para incorporar en alimentos infantiles proteínas con acción protectora frente a microorganismos, incluyendo en este caso a los virus, sería vacunar a las vacas frente a patógenos humanos, y esperar que secretaran en la leche inmunoglobulinas dirigidas contra ellos. Esta aproximación tiene el problema de partida de que, como ya se ha indicado, las vacas secretan IgG, mientras que las inmunoglobulinas presentes en la leche humana son IgA, precisamente las que tienen más actividad como protectoras en el tubo digestivo.
La utilización de una proteína con actividad biológica como ingrediente alimentario hace necesario comprobar, primero, si esa actividad biológica existe en proteínas obtenidas de otra especie o mediante biotecnología, y segundo, si se mantiene a lo largo de los procesos industriales. La alteración general de la estructura, lo que se conoce como desnaturalización, en función de la temperatura y tiempo de los tratamientos térmicos puede observarse con anticuerpos dirigidos contra ella. En el caso de proteínas con actividad antimicrobiana, el factor más importante a tener en cuenta es la pérdida de esa actividad en función de la intensidad de los tratamientos. En este caso en necesario estudiar, en experimentos in vitro, el efecto sobre bacterias o virus.
